2024年2月14日,意昂体育平台未來技術學院分子醫學研究所陳雷研究員課題組在《自然》(Nature)雜誌發表題目為“Structure of human phagocyte NADPH oxidase in the activated state”的文章🕺🏼,報道了人源吞噬細胞NADPH氧化酶處於激活狀態和靜息狀態的高分辨率冷凍電鏡結構👩🏿🔬。

論文截圖
早在1932年🤲🏼,人們就發現白細胞在吞噬細菌的過程中會消耗大量氧氣【1】,這一過程被稱為“呼吸爆發”。1957年🤹🏽,臨床醫生在幼兒中確定了一種可遺傳的先天性免疫缺陷病——慢性肉芽腫(chronic granulomatous disease, CGD)【2】,該病患者會遭受復發性重度細菌與真菌感染,導致感染處肉芽腫的產生。進一步的研究發現這些病人的中性粒細胞雖然能夠吞噬病原體,但缺少呼吸爆發過程,也不能有效地殺滅其吞噬的病原體【3】🚶♂️。隨後幾十年的研究表明吞噬細胞的呼吸爆發是由NADPH氧化酶2(NOX2)復合體介導的氧氣還原過程【4】🂠。吞噬細胞NADPH氧化酶全酶由兩個組分構成,一個是由膜蛋白NOX2和p22形成的膜組分🕵🏿♀️,另一個是由p47、p67、Rac和 p40形成的胞漿組分。在靜息狀態下,膜組分本身不具有活力;而當有病原信號刺激時,吞噬細胞會進行一系列的信號傳導⛏,使胞漿組分的p47等蛋白磷酸化,解除其自抑製的狀態,從而使p47結合膜組分👌,同時招募p67、Rac1、p40蛋白至膜組分並最終激活NOX2蛋白。活化的NOX2蛋白會將胞漿中NADPH上的電子跨膜傳遞給吞噬小泡裏的氧氣,使其還原而生成超氧陰離子,導致氧氣的快速消耗🧍🏻,發生呼吸爆發【5】。NOX2產生的超氧陰離子會進一步在SOD和MPO等酶的催化下產生更具殺傷活力的過氧化氫、次氯酸等物質,用於殺滅包裹在吞噬小泡裏的病原體。
雖然吞噬細胞NADPH氧化酶在天然免疫中具有極其重要的功能👶,但其結構機製研究相對滯後。陳雷課題組於2022年在eLife雜誌報道了NOX2-p22復合體在靜息狀態下的完整結構【6】👯♂️。同年Genentech公司的課題組在《自然·通訊》(Nature Communications)雜誌報道了NOX2-p22跨膜區(TMD)的結構【7】🪡☎。然而這些結構中都不含有胞漿組分,胞漿組分激活吞噬細胞NADPH氧化酶膜組分的分子機製仍懸而未決。
在NOX2早期的研究中常將胞漿組分p47🧜🏼♀️、p67和Rac1的有效片段設計成融合蛋白用於NOX2的體外激活,但由於該融合蛋白親和力較低,在電鏡樣品中難以和NOX2膜組分有效結合,從而導致胞漿組分的電子密度難以被捕獲🥧。為了解決這一問題,作者們一方面將GFP及其納米抗體(GFPnb)分別融合在p22和胞漿組分上以提高它們之間的親和力,另一方面對p47💜、p67和Rac1之間連接序列的長度及其排列方式進行了優化🧝🏼♀️,最終選擇將p22-GFP-p67融合蛋白與NOX2共表達,所形成的復合體能夠被脂修飾的GFPnb-p47-Rac1(穩定結合GTP的Q61L突變體)有效激活,具有較高的NADPH氧化酶活力。作者們最終在同一套冷凍電鏡數據中通過三維分類同時獲得了處於激活狀態並包含有胞漿組分的NOX2的電子密度(2.79 Å)以及處於靜息狀態下不含有胞漿組分的NOX2電子密度(2.99 Å)🥑。
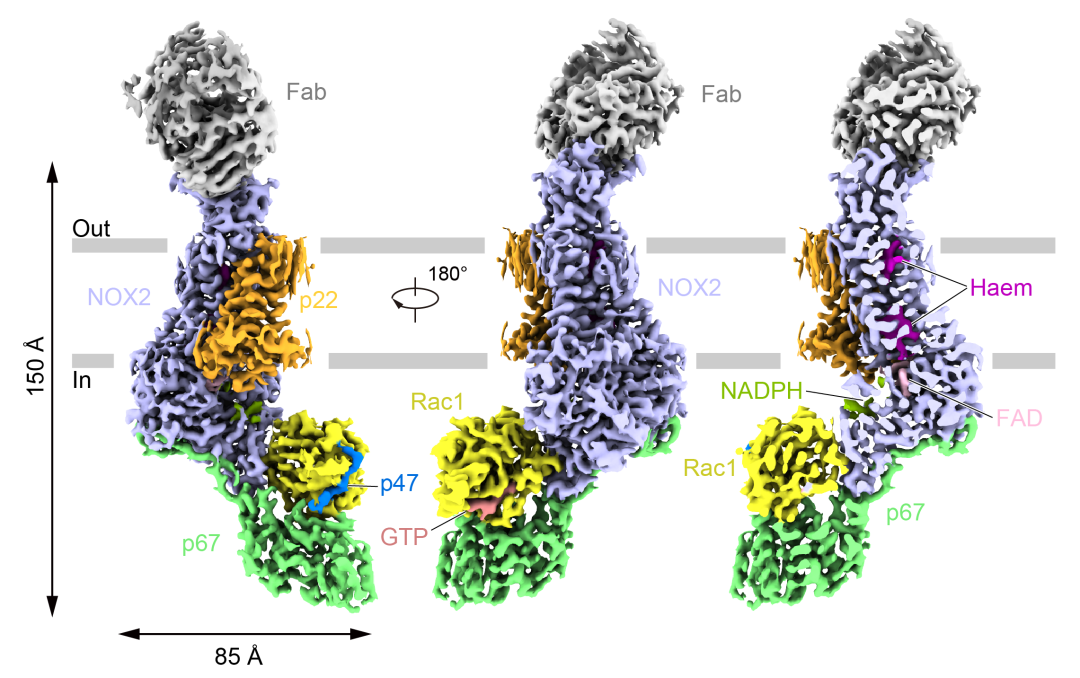
圖1:激活狀態的NOX2復合體的電子密度圖
電子密度顯示:激活狀態的NOX2胞內側與胞漿組分p67、Rac1和p47結合,其中跨膜結構域為NOX家族經典的六跨膜螺旋結構,p67和Rac1組成一個近似“嘴巴”的形狀,p67代表“下頜”🛤,Rac1代表“上頜”🤴🏼,兩者通過氨基酸相互作用夾住NOX2的脫氫酶結構域(DH)。此外,p47上的一段小肽結合在Rac1 α1和β2之間的裂縫中。
p67與DH的結合主要依靠p67 C端向外伸出的激活結構域✦,第202—208位氨基酸形成的β折疊與NOX2的β1形成反平行式排列,與NOX2結合的Rac1處於GTP結合的狀態𓀕。DH與p67和Rac1相互作用界面上的部分氨基酸突變會降低NOX2的活力。同時,數個在CGD患者中發現的突變位點也位於該相互作用界面附近,這進一步說明了該相互作用界面對NOX2的激活至關重要。
通過比較靜息態結構和激活態結構🏋️♂️🖱,作者們發現:在胞漿組分結合後,NOX2的DH結構域會對接到TMD的底部並與TMD的N端形成相互作用。NADPH結合在DH暴露在外側的裂縫中👓,其腺嘌呤基團和磷酸基團和裂縫周圍的氨基酸發生了相互作用✊🏿。
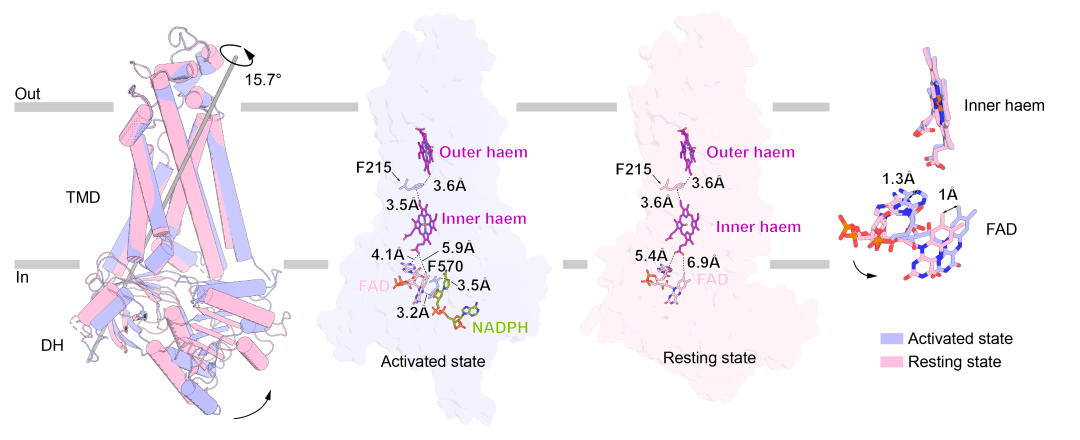
圖2:激活狀態與靜息狀態NOX2的構象變化
NOX2的TMD在激活前後沒有明顯的構象變化,而DH結構域相較於TMD轉動了15.7°🚖,形成一種更為緊湊的構象,也縮短了FAD與近胞質側血紅素之間的距離🏫。FAD結合結構域(FBD)相對於NADPH結合結構域(NBD)產生了17.4°的旋轉🕟,並縮短了FBD和NBD的距離,使位於FBD上的R356靠近NADPH,與其形成相互作用🕴🏼,穩定了NADPH的結合。
通過比較靜息和激活兩種狀態下的NOX2的構象,作者們發現在胞漿組分組裝後,p67-Rac1的結合會導致DH結構域的收縮並對接到TMD上,從而穩定NADPH的結合並將其電子經由FAD、近胞內側血紅素、F215和近胞外側血紅素傳遞到胞外的氧氣,最終產生超氧陰離子🔥👩🏽🏫。
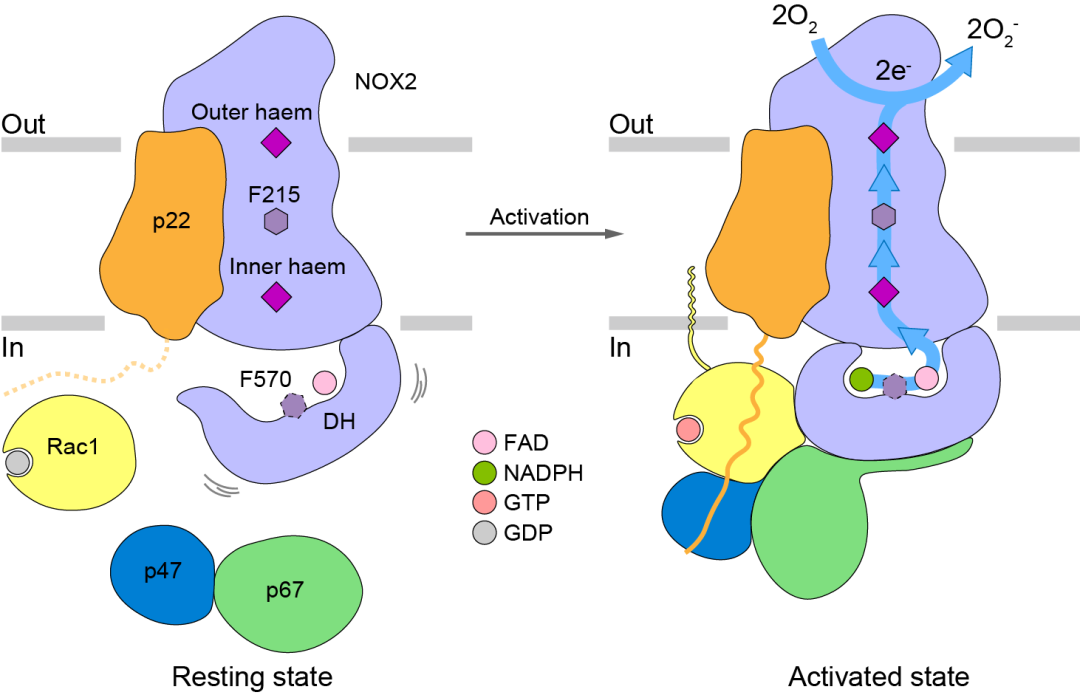
圖3:NOX2激活模型
綜上所述,作者們利用冷凍電鏡對激活和靜息狀態下NOX2的結構進行了解析,從原子水平上觀察到了胞漿組分p67、Rac1和p47是如何與NOX2結合並引起構象變化的🕴🏻,為深入理解NOX2的激活機製提供了結構基礎。
意昂体育平台前沿交叉學科研究院-生物醫學跨學科研究中心博士生劉嘯宇和未來技術學院博士生時亦廷、劉銳為本項工作的共同第一作者,未來技術學院博士生宋康成為該工作作出了重要貢獻💆🏼♀️,陳雷為論文通訊作者。已出站博士後吳驚香(現為中國醫學科學院藥物研究所PI)在課題開展的前期提供了重要支持。
參考文獻
1. C. W. Baldridge and R. W. Gerard. THE EXTRA RESPIRATION OF PHAGOCYTOSIS. in American Journal of Physiology-Legacy Content, 1932, Vol. 103 235-236.
2. H. Berendes, R. A. Bridges and R. A. Good. A fatal granulomatosus of childhood: the clinical study of a new syndrome. in Minn Med, 1957, Vol. 40 309-12.
3. B. Holmes, A. R. Page and R. A. Good. Studies of the metabolic activity of leukocytes from patients with a genetic abnormality of phagocytic function. in J Clin Invest, 1967, Vol. 46 1422-32.
4. J. D. Lambeth and A. S. Neish. Nox enzymes and new thinking on reactive oxygen: a double-edged sword revisited. in Annual Review of Pathology, 2014, 2013/09/21 edn Vol. 9 119-45.
5. C. C. Winterbourn, A. J. Kettle and M. B. Hampton. Reactive Oxygen Species and Neutrophil Function. in Annual Review of Biochemistry, 2016, 2016/04/07 edn Vol. 85 765-92.
6. R. Liu, K. Song, J. X. Wu, X. P. Geng, L. Zheng, X. Gao, H. Peng and L. Chen. Structure of human phagocyte NADPH oxidase in the resting state. in eLife, 2022, 2022/11/23 edn Vol. 11.
7. S. Noreng, N. Ota, Y. Sun, H. Ho, M. Johnson, C. P. Arthur, K. Schneider, I. Lehoux, C. W. Davies, K. Mortara, K. Wong, D. Seshasayee, M. Masureel, J. Payandeh, T. Yi and J. T. Koerber. Structure of the core human NADPH oxidase NOX2. in Nat Commun, 2022, 2022/10/15 edn Vol. 13 6079.
