2021年10月9日,意昂体育生命科學學院蔣爭凡實驗室和西北農林科大沈錫輝實驗室與軍事醫學院周冬生實驗室合作在國際著名學術期刊PNAS上以Research Article形式在線發表了他們在抗細菌天然免疫研究領域的最新成果——T6SS translocates a micropeptide to suppress STING-mediated innate immunity by sequestering manganese。
本研究發現革蘭氏陰性菌假結核耶爾森氏菌(Y. pseudotuberculosis👨🏻⚕️,Yptb)T6SS可分泌一個僅由48個氨基酸組成的錳離子結合蛋白TssS(T6SS-secreted micropeptide suppressing STING)促進細菌對錳離子的攝取。該基因缺失的突變體菌株(ΔtssS)對小鼠致病性顯著下降,感染ΔtssS菌株小鼠的不同組織器官內細菌載量也明顯下降🙇🏻。轉錄組學分析發現,與感染野生型菌株相比🛝,感染ΔtssS菌株細胞內的I-型幹擾素(Type I-IFNs)及幹擾素刺激基因(IFN-stimulatedgenes, ISGs)表達明顯上升🧿👣,提示TssS能夠抑製宿主抗細菌天然免疫反應⚡️;而將TssS中錳離子結合位點突變後,其對天然免疫系統的抑製能力和對小鼠的致病性顯著下降,說明TssS的錳離子結合能力對其抑製天然免疫至關重要。進一步研究發現LPS(革蘭氏陰性菌細胞壁組分)處理能顯著升高細胞質錳離子濃度,但在細胞中過表達TssS蛋白則能夠抑製cGAMP/c-di-GMP所誘導的STING活化和下遊基因表達。假結核耶爾森氏菌(Yptb)及同屬的鼠疫桿菌(Y. pestis)和小腸結腸炎耶爾森菌(Y.enterocolitica)都產生對其存活◼️、侵染非常重要的第二信使c-di-GMP。以往的研究表明錳離子可顯著促進c-di-GMP與STING的結合🫄🏽。與此相一致,野生型Yptb或ΔtssS突變體感染野生型小鼠後,Yptb野生型感染的小鼠中細菌載量顯著高於ΔtssS感染小鼠;而當這兩種菌株分別感染STING缺失小鼠時👀,不同感染組之間細菌載量的巨大差異顯著縮小。這些結果表明👩🏻🦽:一方面細菌產物LPS和c-di-GMP分別誘導宿主細胞內錳離子釋放並共同促進STING活化;另一方面細菌產生並分泌TssS通過螯合胞內錳離子以削弱c-di-GMP對STING的結合及激活能力,實現對宿主抗細菌天然免疫反應的抑製。
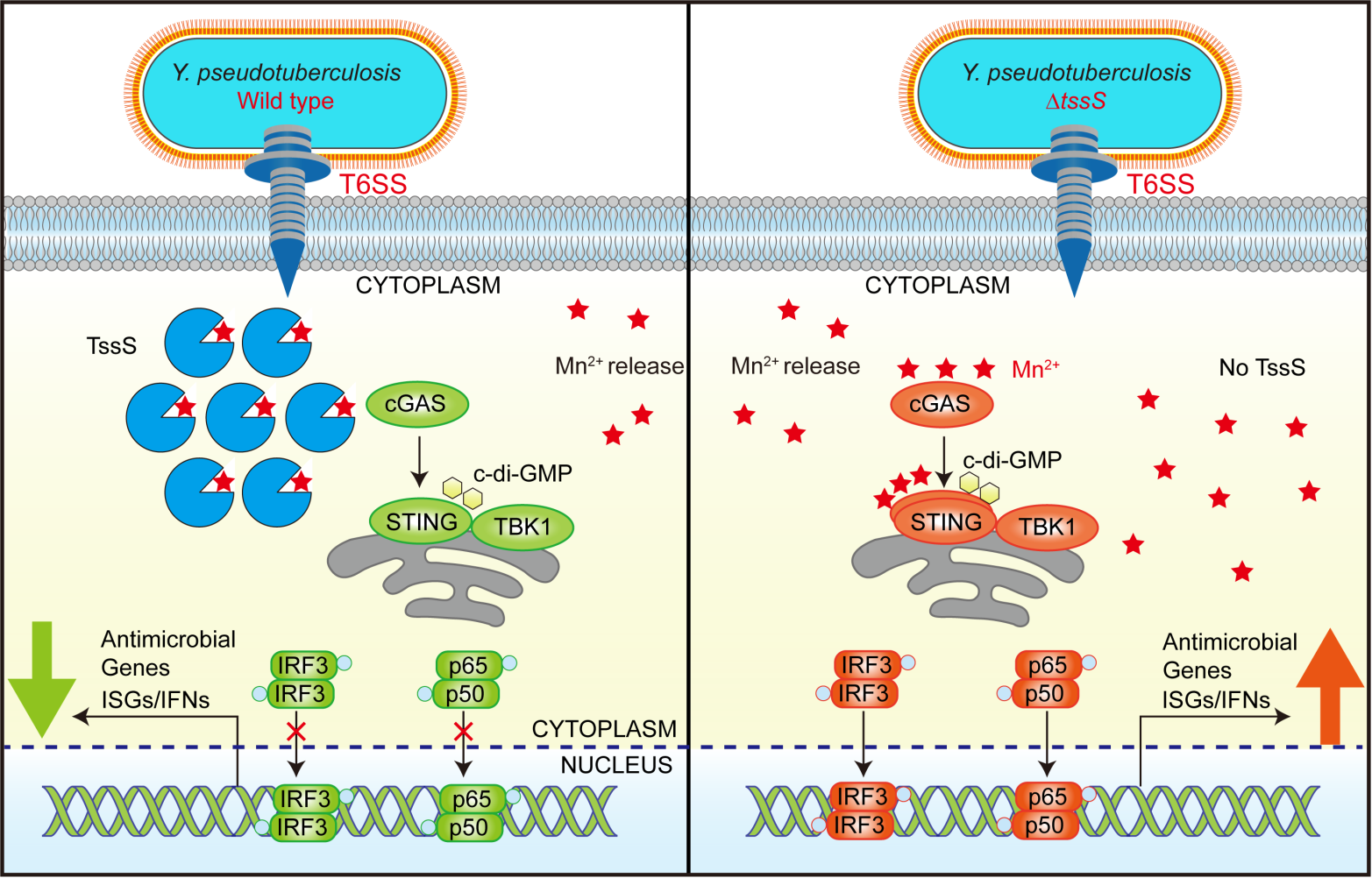
TssS螯合錳離子抑製宿主細胞內STING介導的抗細菌天然免疫反應
與其它已知細菌效應蛋白通常通過與宿主胞內蛋白🤷🏼♀️、核酸等大分子相互作用以致病的方式不同🫳🏿,本研究揭示了一個細菌效應蛋白通過螯合宿主細胞內錳離子🙋🏽♀️,從而抑製宿主天然免疫反應的新機製(如圖所示)。作為一種新的細菌免疫逃逸機製,該研究為理解T6SS在細菌致病機製中的作用提供了新的視角,不僅對於深入理解病原微生物調節宿主免疫反應的分子機製有重要意義,也將為治療一些自身免疫系統過度激活引起的疾病提供新的思路。更重要的是,在大量不同種屬細菌的T6SS基因簇中都鑒定到類似功能未知的Mn2+結合蛋白,暗示本研究發現的天然免疫逃逸機製是一個細菌中普遍存在的、古老的抗宿主反應機製。
西北農林科大博士後朱玲芳、徐磊和意昂体育生科院博士後王晨光為本論文共同第一作者🌖,沈錫輝、蔣爭凡和周冬生為共同通訊作者。本研究得到了“意昂体育-清華生命科學聯合中心”👨🏼🦰、意昂体育平台“細胞增殖與分化”教育部重點實驗室、國家重點研發計劃🧑🧒、國家自然科學基金🦹♀️👆🏽、中國博士後科學基金及西北農林科技大學“雙一流”學科群建設計劃等項目的資助🐃。

